La comunicación entre las células cerebrales es fundamental para la función cerebral. Las células del cerebro se comunican entre sí mediante el intercambio de moléculas de señalización conocidas como neurotransmisores y neuromoduladores. Estos mensajes químicos únicamente se adhieren a células receptoras que tengan celdas o receptores adecuados.
La alteración de la señalización química en el cerebro (química cerebral) es la base de muchos trastornos psiquiátricos, cognitivos y del ánimo. Por ejemplo, una persona puede tener una cantidad demasiado alta o demasiado baja de una molécula de señalización y/o receptor particular. Por ejemplo, un nivel bajo de transmisión de la dopamina está relacionado con la depresión y el trastorno por déficit de atención, mientras que un nivel alto está relacionado con la esquizofrenia. Por lo general, estas condiciones se tratan con medicamentos. La mayoría de las clases de drogas psiquiátricas usadas hoy en día fueron descubiertas por casualidad; su funcionamiento es generalmente un misterio, debido en parte a la falta de tecnología para monitorizar la química del cerebro en forma continua.
Una Ventana Hacia el Funcionamiento Interno del Cerebro
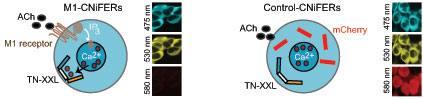
Esta brecha tecnológica motivó a un equipo de investigación de la Universidad de California en San Diego (UCSD, por sus siglas en inglés) a diseñar un sistema adaptable para vigilar los diferentes tipos de receptores y señales químicas en el cerebro. Sus reporteros neurotransmisores fluorescentes basados en células de ingeniería (CNiFERs, por sus siglas en inglés) consisten en cultivos de células que han sido diseñadas para hacer que un receptor específico de interés, junto con una proteína, llamada TN-XXL, actúen para reportar la concentración intracelular de calcio.
Las células biosensoras implantadas se mantienen en el cerebro durante varios días para que los investigadores puedan seguir los procesos que ocurren con el tiempo. Esto les permite a los científicos usar el mismo animal otra vez, una característica importante para el estudio de procesos como la neuroplasticidad (la capacidad del cerebro para cambiar en respuesta a la experiencia) y el sueño.
El equipo utilizó por primera vez los CNiFERs para seguir la actividad de un receptor de acetilcolina (ACh, por sus siglas en inglés), un químico implicado en el aprendizaje, la atención, y la neuroplasticidad. Se cree que la acetilcolina juega un papel en la esquizofrenia. "La farmacología de la esquizofrenia es bastante incompleta. Nadie está realmente seguro de lo que está pasando ", dice el investigador principal del estudio, David Kleinfeld, un profesor de física de la UCSD. Aunque hay fármacos que controlan los síntomas de la esquizofrenia, como las alucinaciones, los delirios, y la apatía, sólo un medicamento en el mercado, la clozapina, tiene algún efecto beneficioso sobre los aspectos cognitivos de la enfermedad, como el aprendizaje y la memoria verbal. "Los síntomas cognitivos de la esquizofrenia se correlacionan más con la capacidad para interactuar socialmente, mantener un trabajo, y funcionar con las actividades de la vida diaria", señala Lee Schroeder, Ph.D., un ex-alumno de doctorado en el laboratorio de Kleinfeld. Una de las hipótesis ha sido que la clozapina afecta la función cognitiva al causar un aumento de acetilcolina en el cerebro. Por otro lado, el fármaco también parece bloquear los receptores de acetilcolina. Esto nos lleva a la pregunta, ¿cuál de estos dos modos de acción predomina?
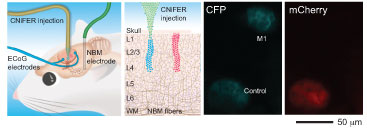
Para responder a esta pregunta, el equipo de investigación implantó CNiFERs que contenían receptores de acetilcolina dentro del cerebro de un animal. Una pequeña parte del cráneo se retiró para crear una ventana por la cual se podían ver las células fluorescentes con un instrumento sofisticado llamado microscopio de barrido láser de dos fotones.
Cuando la acetilcolina se adhiere a su receptor, se produce una serie de eventos dentro de la célula: el calcio es liberado y se une a la TN-XXL, haciendo que cambie su forma ligeramente. Este cambio en su forma reúne a las proteínas fluorescentes de color azul y amarillo en dos ramas de TN-XXL, que a su vez cambia el color de la molécula. En esencia, mientras más amarillo sea el color de la molécula, mayor es la activación de los receptores.
Los investigadores monitorizaron las células durante un período de 6 días. Usando CNiFERs, el equipo descubrió que a pesar de su capacidad para estimular la liberación de acetilcolina, el principal modo de acción de la clozapina es bloquear los receptores de acetilcolina en el cerebro. Este sorprendente hallazgo podría ser informativo para el diseño de fármacos similares, pero con menos efectos secundarios.
La construcción de una Biblioteca CNiFER

Los CNiFERs pueden ser utilizados para medir la actividad del receptor, así como el nivel de las moléculas de señalización en respuesta a la manipulación farmacológica o la estimulación eléctrica. Alentado por el éxito de la primera aplicación de CNiFERs, el laboratorio de Kleinfeld está avanzando hacia la prueba de otras moléculas. El diseño modular del sistema permite la creación de nuevos CNiFERs que combinan las células que contienen TN-XXL con varios receptores. En la actualidad, el equipo se está enfocando en los receptores acoplados a la proteína G, que son el blanco de aproximadamente el 50% de los medicamentos neuropsiquiátricos en uso hoy en día.
El grupo está explorando las moléculas de señalización que afectan a los vasos sanguíneos en el cerebro. Debido a que toda la actividad cerebral se acompaña por cambios en el flujo sanguíneo local, el equipo espera "crear sensores para ver el espectro de las moléculas que cambian la constricción de los vasos sanguíneos y poder utilizar esos sensores en el cerebro", indica Kleinfeld.
Pul Slesinger, profesor asociado de los Laboratorios para la Biología del Péptido de La Fundación Clayton del Instituto Salk, está colaborando con el equipo de Kleinfeld para construir una biblioteca de CNiFERs que responda a neurotransmisores específicos, incluyendo a los transmisores de neuropéptido. El laboratorio de Slesinger está interesado en el uso de CNiFERs para estudiar los mecanismos moleculares de la adicción a las drogas. "Nos gustaría monitorizar los niveles de dopamina en modelos animales específicos de la adicción", indica Slesinger, "y uno de los obstáculos que estamos tratando de superar es la medición de la actividad en las zonas profundas del cerebro". La imagen profunda es difícil, aunque físicamente posible, y es aquí donde la colaboración entre Kleinfeld y Slesinger bien podría brillar.
Los CNiFERs ofrecen una oportunidad abierta para llegar a una comprensión profunda de la biología básica del cerebro y evaluar nuevos medicamentos. "La capacidad de medir cómo la química del cerebro está cambiando de un momento a otro es fundamental para la neurociencia", dice Schroeder. Si tienen éxito, los CNiFERs serían la primera herramienta que podría medir con éxito los neuropéptidos in vivo.
Este trabajo está apoyado por el Instituto Nacional de Bioingeniería e Imágenes Biomédicas, el Instituto Nacional sobre el Abuso de Drogas, y el Instituto Nacional de Salud Mental.
http://www.sciencedaily.com/releases/2009/12/091213164707.htm
