Dos de los mayores objetivos en la investigación de la enfermedad de Alzheimer son el diagnóstico a tiempo y las terapias de medicamentos para modificar el resultado de la enfermedad. El conseguir esta metas podría alterar dramáticamente el tratamiento actual para esta afección progresiva y degenerativa que ataca las células nerviosas del cerebro, o neuronas, y priva a las personas de su memoria y su capacidad de razonar, de comunicarse, y de llevar a cabo sus actividades diarias. Al día de hoy, la única manera de poder diagnosticar esta enfermedad definitivamente es a través de una autopsia.
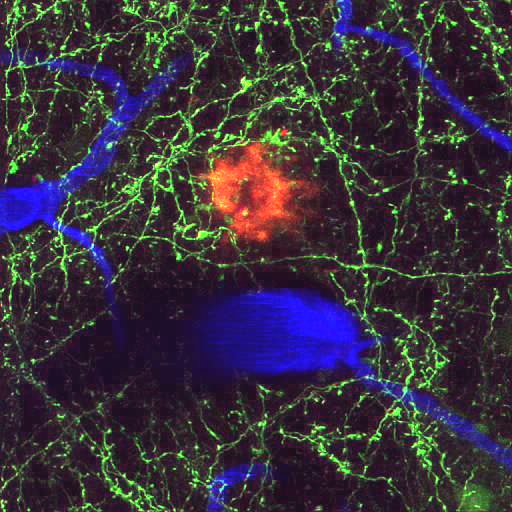
Lo que los investigadores sí saben es que dos tipos de lesiones anormales obstruyen el cerebro de personas con Alzheimer: las placas beta-amiloides – depósitos pegajosos de fragmentos de proteínas y material celular que se forman por fuera y alrededor de las neuronas; y los ovillos neurofibrilares – fibras entrelazadas insolubles compuestas principalmente de la proteína tau que se acumula dentro de las células nerviosas.
Para entender mejor el inicio y el curso de esta enfermedad, investigadores en el Hospital General de Massachusetts en Boston combinaron modelos de ratones, una tecnología actual de imágenes ópticas – microscopía multifotónica (MPM) – y agentes únicos de visualización. Su trabajo es un paso importante para evaluar el avance de la enfermedad de Alzheimer, y podría acelerar el descubrimiento de medicamentos para tratar la enfermedad y cambiar su curso.
“Tenemos un conocimiento limitado de la evolución de la enfermedad”, dice Brian Bacskai, Profesor Asociado de Neurología en el Hospital General de Massachusetts en Boston. “La microscopía MPM nos permite ver lo que sucede cuando se enferma el ratón y podría proporcionar intervenciones terapéuticas”.
Imágenes de Alta Resolución
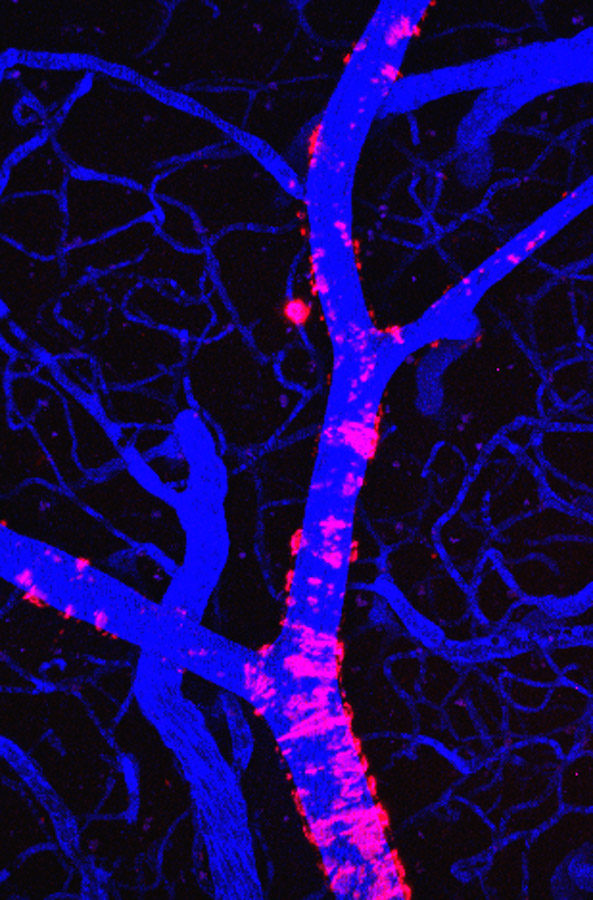
Esta tecnología tiene varias ventajas sobre otros métodos de obtención de imágenes. Los rayos infrarrojos utilizados en la microscopía MPM penetran profundamente en el tejido vivo sin dañarlo. Los métodos tradicionales utilizan pigmentos que requieren de luz ultravioleta que puede dañar las células vivas. La microscopía MPM ofrece una resolución de 1 µm – 1,000-veces mayor que la resolución obtenida con tomografía por emisión de positrones (PET). La microscopía MPM revela neuronas, placas y vasos sanguíneos individuales en el cerebro, cuando se combina con agentes especiales de obtención de imágenes. Todo esto se puede hacer en el cerebro intacto de un ratón vivo, pero el método requiere de un acceso óptico al cerebro, lo cual implica implantar quirúrgicamente una ventana craneal en una región del cráneo.
Para obtener imágenes de las placas en humanos, los investigadores utilizan la tomografía PET. Aún cuando es más sensible para identificar placas y puede obtener imágenes del cerebro completo, la tomografía PET no muestra los depósitos individuales de placa. “Con la tomografía PET puedes determinar la cantidad de placa promedio por milímetro cúbico de cerebro”, dice Bacskai, mientras que “la microscopía MPM te muestra exactamente cómo se ve el cerebro, pero sólo puedes tomar imágenes de una pequeña parte del mismo”. Aunque la microscopía MPM sólo obtiene imágenes a una profundidad aproximada de 500 µm, permite encontrar depósitos amiloides en la corteza superficial, cerca de la superficie del cerebro.
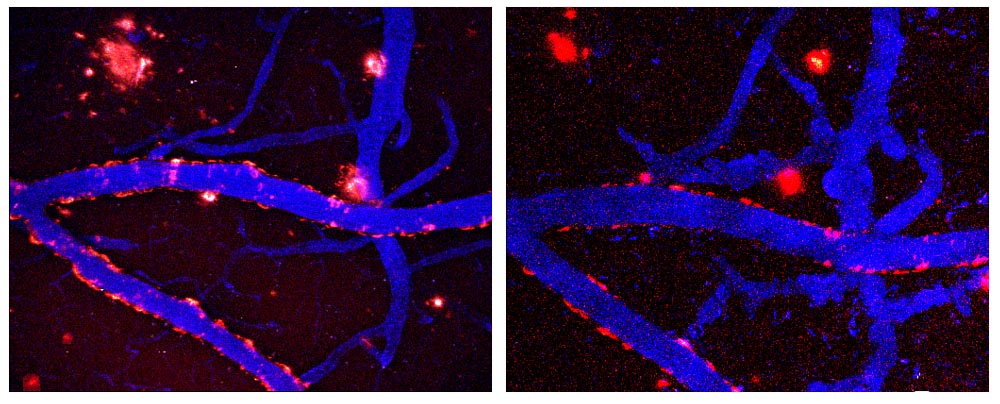
Reduciendo la Acumulación de Placa
El método de Bacskai puede mostrar “la relación dinámica que hay entre la anatomía y la fisiología en el cerebro vivo”, explica David Holtzman, Presidente del Departamento de Neurología en la Escuela de Medicina de la Universidad de Washington. El dice que la técnica es particularmente útil para estudiar la angiopatía amiloide cerebral (CAA), la cual se forma por la acumulación de péptidos amiloides-β (Aβ) en los vasos sanguíneos del cerebro. Aβ es también la proteína principal que se encuentra en las placas amiloides que se forman en el cerebro con Alzheimer. En la angiopatía CAA, la proteína Aβ se acumula en la pared de pequeñas arterias en el cerebro y puede ocasionar sangrado.
En un estudio reciente, Bacskai y su equipo utilizaron la microscopía MPM para monitorear la depuración de péptido amiloide-β de la angiopatía CAA. La angiopatía CAA se asocia comúnmente con el Alzheimer, pero es también la causante de algunos infartos cerebrales en los ancianos. “Esta es una condición alarmantemente poco estudiada”, dice Bacskai, añadiendo que el 80 por ciento de los casos de Alzheimer tienen angiopatía CAA.
Los investigadores descubrieron que al administrar un anticuerpo dentro del cerebro continuamente por un periodo de dos semanas, la angiopatía CAA desaparecía de los vasos sanguíneos sin evidencia de hemorragia. Esto fue en contraste con una sola dosis de anticuerpo administrada directamente al cerebro, que resultó en una depuración inicial de la angiopatía CAA, seguida de un crecimiento disparado de los depósitos. Al determinar el patrón de crecimiento de la angiopatía CAA, el equipo pudo mostrar que la inmunoterapia se puede acondicionar para tratar ambos el Alzheimer y la angiopatía CAA.
Sus descubrimientos podrían ser significativos, ya que el primer estudio clínico en grande que utilizó un método activo de inmunoterapia con un compuesto llamado AN1792 (una versión sintética de la proteína beta-amiloide) fue interrumpido por causar inflamación cerebral en cerca del 6 por ciento de los participantes. “Cuando ciertos anticuerpos para Aβ interactúan con la angiopatía CAA, pueden ocasionar pequeñas y a veces grandes hemorragias”, dice Holtzman. “El trabajo de Brian podría ser la solución para este problema”.
Probando Nuevos Agentes de Imágenes y Medicamentos
El trabajo desarrollado por el equipo de Bacskai ofrece también una oportunidad para probar un rango más amplio de medicamentos. “Si podemos determinar los pasos clave en la evolución de la enfermedad, podremos entonces tratar de modular estos pasos y ver si se logran cambios en el curso de la enfermedad”, explica Steven Greenberg, Director de Investigación en Ataques Hemorrágicos en el Hospital General de Massachusetts y colaborador de Bacskai. “Este trabajo aminorará el proceso de identificar un grupo convincente de medicamentos potenciales que podrían modificar cómo avanza la enfermedad”.
En otro estudio reciente, Bacskai y su equipo encontraron que la curcumina, un pequeño compuesto fluorescente de la especia india turmerico (curry), puede afectar las placas amiloides existentes y restaurar parcialmente las estructuras cerebrales dañadas por la enfermedad en el cerebro del ratón.
A pesar de que los investigadores no pueden utilizar la microscopía MPM para obtener imágenes en humanos, la investigación de esta tecnología puede proporcionar información importante acerca de los compuestos que podrían ser relevantes para la obtención de imágenes médicas. En el caso de un agente de imágenes llamado Compuesto B Pittsburgh (PiB), desarrollado por William Klunk y Chester Mathis en la Escuela de Medicina de la Universidad de Pittsburgh, Bacskai y su equipo demostraron en el modelo de ratón que el PiB entra rápidamente al cerebro, se une a los depósitos amiloides en cuestión de minutos, y se elimina del cerebro enseguida. Los investigadores concluyeron que este descubrimiento resultaría directamente en imágenes exitosas de humanos. Un estudio clínico de 25 centros está en proceso de probar el PiB como método para identificar las placas amiloides.
La Función en Imágenes Humanas
“La microscopía MPM es una herramienta que puede acelerar el desarrollo de otras herramientas para la obtención de imágenes de la enfermedad de Alzheimer en los humanos”, dice Bacskai. “Para lograr ese paso [hacia imágenes humanas] necesitamos desarrollar más y mejores instrumentos para tomografías PET, SPECT, y MRI”. La microscopía MPM permite a los investigadores estudiar una variedad de sondas o marcadores, agentes que se adhieren a una sustancia identificada (en este caso, depósitos amiloides). Pueden monitorear cómo estos marcadores atraviesan el cerebro y determinar a qué sustancias o estructuras se adhieren. Aunque todavía queda mucho trabajo por hacer, Greenberg se siente optimista acerca del papel de la microscopía MPM en la búsqueda de nuevos tratamientos para la enfermedad de Alzheimer. “Hacer una prueba de medicamentos es muy costoso y complicado, como construir un crucero de lujo”, dice Greenberg. “Lo que hace útil a la microscopía MPM es que nos muestra en forma directa cómo evoluciona la enfermedad. Podemos evaluar agentes que parecen tener sentido biológicamente, pero necesitamos más evidencia para corroborarlos antes de proceder a un estudio clínico en grande”. “Hay muchísimo más por hacer”, añade Bacskai.
Este trabajo está apoyado en parte por el Instituto Nacional de Bioingeniería e Imágenes Biomédicas (NIBIB) y el Instituto Nacional sobre Envejecimiento (NIA).
Referencias

